研究紀要第6号 学習指導改善に関する研究 理科実験 - 036/036page
各時刻の平均の速さ(吸光度の平均変化率)と
の濃度(吸光度)をプロットとすると図8になる。
4.教材としての取り扱い
(1) 次のような展開が考えられる。
① 反応の速さが,反応系の物質の濃度の減少とは逆に,しだいに増大するのはなぜだろうか,を考えさせる。図7のグラフだけでもわかるが,必要によっては図8のグラフを書き,反応系粒子の衝突モデルでは説明できないことを確かめる。
② 「反応熱によって液温が上昇するためではないか。」「反応が進むにつれて生成する物質,Mn2+や,CO2()の影響ではないか。」などの考え方を導く。
③ ②の考え方が正しいかどうかを検証する。
液温の変化は,1~2°にすぎないので影響が少ないこと。の添加は影響しないこと。多量のMn2+添加は,反応を瞬間的に完了させること,などを実験で確かめる。
(2) 測定上の留意点
比色計セルにとった液の方が反応が速く進む(液温の上昇)ので,吸光度を測定するたびに液を取り替えた方がよい。
Ⅳ 反応物質に関し0次の反応について
1.アセトンのよう素化反応の速さとI2の濃度
アセトンとよう素水溶液を反応させると,式
の変化が起こり,よう素の色がしだいに消える。
I2十CH3・CO・CH3→ I・CH2・CO・CH3+H++I-……
この反応はH+が触媒となり,次の段階を経て反応が進行するといわれている。(文献2)
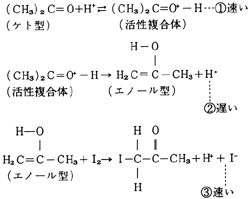
律速段階は②式で,よう素の関係する段階③式は全反応の速さに影響しない。すなわち,よう素の濃度は反応の速さに関係しない(0次である)。反応系物質の中に,その濃度が反応の速さと全く関係しないものもあるという事実は,粒子の衝突モデルなどでは予想もできないことである。こういった事実から,多段階反応,律速の概念へと発展させることが,実際の指導では重要と思われる。
この反応の反応速度の測定は,昭和44年度福島県理科教育センター長期研修生研究集録「有機化合物を教材とした反応速度の実験2題:蓬田道郎」にすでに報告されているので,詳細はそれによられたい。次はその追試例である。
2.測定例
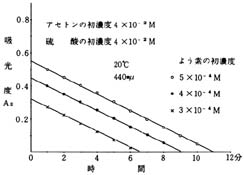
アセトン,H+,過剰のもとで,アセトンとよう素を反応させ,よう素の色を光電比色計で測定すると,図9のようになる。よう素の消失の速さは,よう素の濃度に関係なく常に一定である。図9の例では,どの場合も,吸光度の変化率(直線のこうばい)が-0.05/分である。
図9 よう素の消失の速さとよう素の濃度
Ⅴ おわりに
どの場合も,反応機構に深入することを避け,測定事実を中心に扱いたい。
〔参考文献〕 1. 有機反応機構研究法 N.S.ISAACS(広川書店) 2. 化学反応はいかに進むか E.L.KING(化学同人) 3. 昭和44年度 長期研修生研究集録 (福島県理科教育センター)