研究紀要第6号 学習指導改善に関する研究 理科実験 - 035/036page
(3) 指導上の留意点
指導に際しては,次のことをおさえる必要があろう。
① 化学反応の速さは,反応系の物質の濃度の平方根や平方などに比例する場合もあること。
② 反応の速さと濃度の関係は,実測によってだけ求められ,化学量論的な化学反応式ではわからないこと。
③ 反応速度の測定などから,逆に,化学反応の機構などがあきらかにされること。
Ⅲ 過マンガン酸カリウムのしゅう酸による還元の速さ(自触反応の例として)
1.測定の目的
過マンガン酸イオンはしゅう酸イオンによって,次式のように還元される。
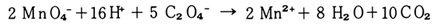
しゅう酸イオン,水素イオンの過剰のもとでこの反応を進行させ,の濃度変化を光電比色計で追跡し,反応速度を求める。この場合は
の濃度減少とは逆に,反応の速さが速くなることを知り,その原因を考察する。
2.測定方法
(1) 試薬
1×10-3M KMnO41×10-1M H2C204
0.1M,1M,2M,4MのH2SO4
(2) 方法
過マンガン酸カリウム水溶液10mlと希硫酸5mlに,しゅう酸水溶液10mlを加え,水で全体積を50mlにして反応させる。(Ⅱの実験のように,2本の25mlメスシリンダーを用いる。)
希硫酸だけは,測定に都合の良い速さをさがすため,濃度を変える。
混合した液を一定時間ごとに,光電比色計(島津sp20)のセルに取り,53mμにおける吸光度を測定する。
3.測定結果
図7に示したように,硫酸の濃度がうすい場合は,反応の速さが遅く,ある時間までは,一定の割合で吸光度が減少する。したがって長時間の測定をおこなわないと速さの変化がわからない。
混合時の硫酸の濃度を0.2~0.4Mにすれば,10~5分間で速さの変化が測定できる。後半の反応の速さは,かなり速く,比色計の指針の動きを見るだけで,速さの差がわかる。反面,タイミングの関係で,後半の測定値は再現性が悪くなる。