研究紀要第33号 学習指導に関する研究 - 056/092page
A社はアニリンとニトロべンゼンのところに大きなピークがあり,B社はニトロベンゼンのところがピークになり,C社はアニリンが鋭いピークを構成している。
A,B,D社は水素発生が止まった後も未反応のニトロベンゼンがあるので明らかに,塩酸,スズの不足が考えられる。表6から未反応のスズが残っているのでスズは不足していないようだが,C,F社の状態から考えて,スズが相当量残る位加えておく必要があるように考えられる。B,D杜はほぼ等しいスズを使いながら未反応のスズの多いのは,加熱の仕方に問題があったのかも知れない。C,E社はニトロベンゼンが0.5mlなのでこれを1mlに換算すると反応したスズはそれぞれC社が2.56g,E社が1.50gとなり,生成したアニリンの量は,スズの反応量の多いものほど多く生成している。しかも,スズの反応量が1.0gから1.5gにかけて急激にアニリンの生成量が増加している。2.0g前後からは生成するアニリンの量の増加の割合は小さくなっている。
スズの量に対して塩酸の量を増加させて,急激に水素を発生させるのがよい方法なのかも知れない。
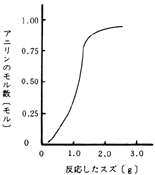
図4 反応したスズと生成したアニリンの関係
4.ニトロベンゼンの還元に必要なスズと塩酸の量
ニトロベンゼンの還元は普通次の化学反応式で表わされる。
2C6H5NO2+3Sn+12HCl→
2C6H5NH2+3SnCl4+4H20この式によって計算すると1mlのニトロベンゼン(ニトロベンゼンの比重1.20)に対して,スズ1.74g,濃塩酸(比重1.18,濃度36%)5.0ml必要になる。この計算によると濃塩酸は5mlで十分であるから教科書の指示は一応正しいと考えられる。一方スズの場合,反応を完結させるには最低1.74g必要なのに対して普通市販されているスズの粒はそれ程大きくないので,C社を除いては最初から不足量を使用させていることになる。スズの量を質量で指示する方がよいのではなかろうか。
(今度の実験で使用したスズの5個の合計平均質量は1.64gである。)
表7 反応したスズと塩酸の量
表5に従ってスズと反応した塩酸の量を計算すると表7のようになる。
加熱しても水素が発生しなくなるまで反応させていたので塩酸はほとんど残っていないと考えてよい。しかし,表7からわかるように,実際に水素の発生に消費された割合は少ない。塩酸は加熱によって失なわれるものが相当あると考えなければならない。さらに,生成したアニリンと反応する塩酸を考慮しなければならない。
ブルースターの有機化学には次式の反応式がのっている。
2C6H5NO2+3Sn+14HCl→
2C6H5NH3Cl+3SnCl4+4H2O