研究紀要第33号 学習指導に関する研究 - 060/092page
ロアニリンとp-クロロアニリンの副反応生成物ができる。
直火で加熱したときはo-化合物とp-化合物の生成する割合は一定していないが,大体p-化合物の生成量が多い。水浴器で加熱したときにはその生成する割合%は,ほぼ2.0~2.2位になってくる。また,前述したようにスズの量を一定にしたときは,塩酸の量を増加させていくと,副反応生成物の量が多くなる。塩酸の量を一定にしてスズの量を増加させると,その量は減少する傾向がわかる。これらの化合物の生成はサラシ粉による呈色ではわからないが,TLCで展開すると完全に確認することができる。この還元反応でどのような過程をとってクロロアニリンが生成するか,はっきりしない。しかし有機化学の本には次のような記述がある。
「濃塩酸溶液中で処理する場合に限って,ヒドロキシルアミン階程からおそらく生ずるものと思われる塩素を含有する副生成物がしばしば現われる」として次式が書かれている。
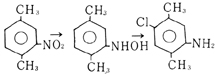
また,アニリン誘導体の分子内転位反応において窒素原子から環への転位の例が数多くある。
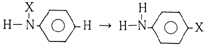
ここでXは-OH,ハロゲンなどでもよいといわれている。例えば,N-フェニルヒドロキシルアミンからp-アミノフェノールの生成など,このような転位反応では,普通パラ位への転位が優先的におこるが,オルト位も同じように生成することがある。或いは,分子の窒素原子から脱離した置換基が,隣接する他分子のオルトまたはバラ位の炭素に転位することもある。このような反応から副生物が生成しているのかも知れないが,完全には調べてはいない。
8.まとめ
高等学校におけるニトロベンゼンを還元して,アニリンをつくる実験室的製法を検討してみると,多くの教科書に指示されている試薬量では反応が十分に行なわれないで,ニトロベンゼンが相当残ることがわかった。
エーテル抽出液中にアニリンを90%以上含有させるのには,ニトロベンゼン1ml(1.2g)に対して,スズは5g以上,濃塩酸は8ml以上使用するのがよい。この場合スズは相当残るけれども何回も使用できる。
加熱は試験管を直接アルコールランプなどで加熱する。但し,この場合,激しく沸騰させないで,水素が激しく発生しはじめたならば加熱を止めてよい,そうすることによって突沸も防ぐことができる。
生成物の検出,確認には従来のサラシ粉による方法でなく,ベンゼン・メタノール・酢酸の混合溶液を展開溶媒にして,TLCを用いて混合物を展開する。
最後にヨウ素蒸気による呈色を利用すれば,4つの物質を確実に分離・確認できる。このような新しい方法を導入することは有機化学の反応を理解させる上において非常に有効な方法である。
今後広く活用していきたい。
参考文献 ブルースター有機化学(下) 東京化学同人 カラー 有機化学Ⅱ 共立出版 芳香族置換反応 東京化学同人 薄層クロマトグラフィーの実際 鈴木郁生 広川書店 ガスクロマトグラフ法の手ほどき 高山雄二 南江堂 高等学校教科書 化学Ⅱ 各出版社 化学教育 20巻3号P.243 日本化学会