研究紀要第6号 学習指導改善に関する研究 理科実験 - 034/036page
図5 pH3.3で反応させたときの変化
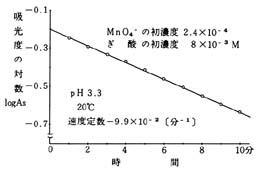
図5から,一次反応とみなして,速度定数を求めると,9.7×10-2〔分-1〕の値を得る。
5.考察
(1) 教材としての取り扱い。
A→生成物 という反応で,反応の速さがAの濃度に比例する場合,Aの初濃度をa,時間tにおけるAの濃度を(a-x)とすると,
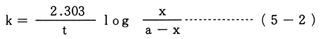
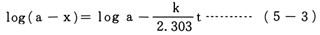
このような数式変形を理解できる場合は,図3,図5のようなグラフを書いて,結果を考察させることもできるが,高校では,数学との関連もあり,取り扱いにくい。
高校段階では,次のような扱い方が適当と考える。
①吸光度の変化のグラフ(図2)を見て,の消失速度がだんだん遅くなることに,まず,気づかせる。
②各時刻における平均の速さ(吸光度の平均変化率)を計算させる。例えば,1.5分後の平均の速さ(As/分)を,1分後と2分後の吸光度の差から求める。
③各時刻の平均の速さとの濃度(吸光度)の関係をグラフに書き,考察させる。
④グラフ(図6)から,一定の時間までは,反応の速さが,の濃度に比例していることを確かめる。
⑤反応の終わりの方では,マンガン酸化物のため,比色定量が妨げられていることを,観察事実(溶液の色,長時間放置したときの沈でん生成など〉から,指導する。⑥ 数式を用いる場合は,次の程度とする。
反応の速さが,の濃度Cに比例するとすれば,dc/dt=kc したがって,
dc/dt÷C=k(一定)
(平均の速さ)÷(濃度)≒一定
この関係が,成り立つかどうかを,表3のようにして確かめる。
表3 データ処理の例
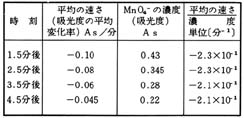
(pH6.9,の初濃度2.4×10-4M)
(2) 測定条件について
(1)で述べたように,高校では,測定した吸光度の値をそのままプロットしたグラフ(図2,図4)を用いる方が,指導しやすい。しかし,図4のグラフ(pH3.3で反応)では,変化が小さく,反応の進行にともなう速さの変化がはっきりしない。pH7の条件で反応させた図2のグラフならば,速さの変化がよくわかる。この測定では,反応の速さを適当な速さに設定することが必要である。pH7のときの反応の速さ(速度定数-2×10-1〔分-1〕)ぐらいが適当と思われる。
なお,pHの値によって反応の速さが変わるの