きる,いわゆる中和の反応をイオンの生成と,その結合までのプロセスについてのシミュレーションのハードコピーである。
1(丸囲み)は,HCIの分子2個とNaOH2個を準備し,2(丸囲み)の位置までゆっくりと移動する。
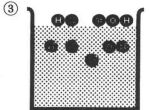
次に,3(丸囲み)では,水中に入り,それぞれがイオン化し,4(丸囲み)ではOH-とH+イオンが結合し,電荷を失い「水」になり,更に,Na+イオンとClイオンが存在する状況を示している。
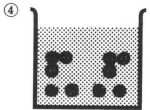
5(丸囲み)の段階で,水が水蒸気となり,水量が順に減少していく状況を示し,6(丸囲み)の水が蒸発後において,Na+イオンとCl-イオンが,それぞれ電荷を失い,結晶の形でNaCl(食塩)が析出する状況を示している。
次に,図−4は,HCl分子の数よりNaOHの数が多い場合1(丸囲み)で,次にこれらが順に移動し2(丸囲み)のようになり,更に3(丸囲み)のように,それぞれがイオン化し,を経て,5(丸囲み)のように,それぞれの分子が結びつき「水」をつくり,Na+イオンとOH-イオンが残った状況を示す。
6(丸囲み)は,この溶液に,リトマス液を滴下するとたちまち,青色に変色するようになっている(グラビア参照)。さらに,その液の中では,OH-イオンの部分が点滅するようになっており,青色の塩基性(アルカリ性)の原因を説明できるように配慮してある。
図−5は,図の4の逆の現象の説明で,H+イオンが最後に残り,リトマス液の滴下後にビ−カー内が赤変するようになっている。
3.まとめ
このようなシミュレーションは,動的に理解され,定着率も大きいと考えられるが,実験後における現象・原理の把握をさせる場面で利用することが望ましい。
|
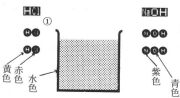
化学反応をはじめますエンターキーを押して下さい。
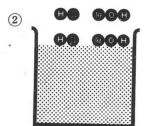
キーを押してください。画面が止まります。
溶解とイオン化
キーを押してください。画面が止まります。
水分子の生成
キーを押してください。水が蒸発します。
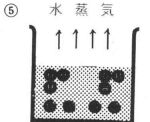
水の蒸発
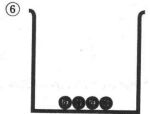
NaClの結晶の析出
|