|
|
|
福島県教育センター所報 第4号(S46/1971.12) -003/025page
|
|
|
(3) 測定上の留意事項
Mg,Ca,Liの塩化物は,長く保存したものをそのまま用いると,溶解熱の値が小さくなる。使用する前に加熱して,乾そうさせるとよい。
表4 保存物の測定例
塩化物 溶解熱kcal/モル 測定値 文献値 LiCl +5.6 +8.5 CaCl 2 +16.5 +19.8 (4) 測定後の指導
表5 陽イオンの価数と塩化物の溶解熱
陽イオン Li + Mg 2+ Na + Ca 2+ イオン半径 0.68Å 0.66Å 0.97Å 0.99Å 塩化物の溶解熱 8.4kcal 37kcal −1kcal 19kcal
[3] 水分子の極性や結晶の格子エネルギー(表6)を導入し,強く結合しているイオン結晶が簡単に溶解するのは,溶媒と溶質の相互作用にもとづくこと,溶解によって水と陽イオンや陰イオンの間に新たな結合が生じることをモデル図などで説明する。
図2 イオンの水和
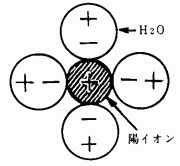
表6 結晶格子エネルギー
塩化物 格子エネルギー 塩化物 格子エネルギー LiCl 202kca1/モル MgCl 2 598kca1/モル NaCl 184 〃 CaCl 2 535 〃 KCl 169 〃
<実験> これらの塩類が有機溶媒にはほとんど溶けないことを観察させる。
[4] 溶解熱の測定値,結晶格子エネルギーの値を用いて,各状態のサイクル図を書かせ,溶解熱に正・負があることを,水和エネルギーと格子エネルギーの関係からとらえさせる。
水和エネルギー>格子エネルギーの場合:溶解熱は正
水和エネルギー<格子エネルギーの場合:溶解熱は負
図3 エネルギーサイクル
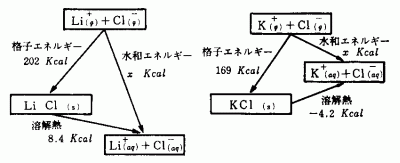
図3を書かせる場合,矢印の方向を特に注意する。
[5] ヘスの法則を適用して,各塩化物の水和エネルギーを計算させる。
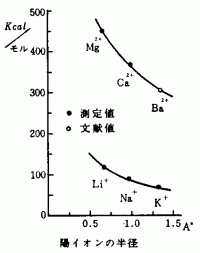
[6] Cl − の水和エネルギーの値(92kcal/モル)を与え,塩化物の水和エネルギーからCl − の分を除いた値,すなわち陽イオンだけの水和エネルギーを求めさせ,図4のようなグラフを書かせる。
クーロンの法則
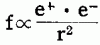
などからグラフを解釈させる。
図4 陽イオンの水和エネルギー
3. 液体を混含した際の温度変化(エンタルピ変化)
Nuffield Advanced Scienceでは分子間力,水素結合の導入に,つぎのような測定をおこなっている。
<方法>
(1)等体積ずつのアセトンとCH 2 Cl 2 ,CHCl 3 ,CCl 4 ,をそれぞれ混合し,温度変化を測定する。
(2)エタノールとシクロヘキサン,1―プロパノールと2―プロパノールについても同じように測定する。
<測定例> 20mlずつをポリエチレンびんの中で混合する。
混合系 温度変化 a.CH 2 Cl 1 ―(CH 3 ) 2 CO +6.8゜ b.CHCl 3 ―(CH 3 ) 2 CO +12.2゜ c.CCl 4 ―(CH 3 ) 2 CO −0.3゜ d.エタノール―
シクロヘキサン−3.5゜ e.1―プロパノールー
2―プロパノール―+0.2゜ <考察>
(1) CH 4 の塩素置換体やアセトンの構造式,極性,測定結果から,分子間結合は塩素置換体のH原子とアセトンのO原子との間におきていることを見つけさせる。
(2) c,eの場合は分子間の相互作用がほとんどなく,dの場含は混含により結合が切断されたと推論させる。
|
|
|