|
|
|
福島県教育センター所報ふくしま No.18(S49/1974.11) -014/025page
|
|
|
銅の酸化物の質量(g) 0.5 1.0 1.5 銅の折出料 酸化銅(I)(g) 0.35 0.65 1.0 酸化銅(II)(g) 0.2 0.4 0.5 横軸に銅の塩化物の質量、縦軸に析出した銅の質量をとってグラフを書く。
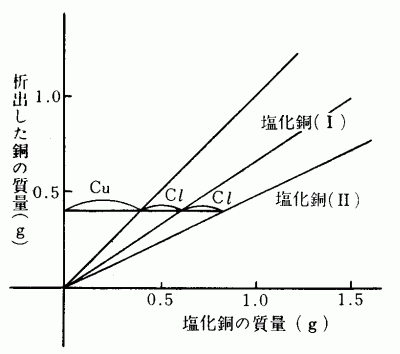
但し、塩化銅(II)CuCl 2 ・2H 2 Oは含水結晶なので方法(1)の質量をグラフ上に表してもCu対Clの結合比を求めることができないので、CuCl 2 ・2H 2 O中に含まれるCuCl 2 を計算で求め、この値を横軸にとってグラフを書かなければならない。
CuCl 2 ・2H 2 Oの質量 0.5g 1.0g 1.5g CuCl 2 の質量 0.39g 0.79g 1.18g グラフからCuに化合するClの量が1:2になっていることがわかる。
実験上の問題点
(1) 方法(2)、(3)と乾燥に時間がかかる。
(2) 乾爆を高温で行うと、銅の表面が酸化される。
(3) 酸化銅の水素による還元実験は、危険を伴うので、安全教育上生徒実験には好ましくない。II 気体反応における体積関係の測定
気体同志の反応における体積測定の実験は、従来からユージォメータによる水素と酸素との反応を利用してきた。気体反応の法則を帰納的に求めるような時、或いは水素・酸素の反応の後に、他の気体同志でも体積比が整数比になる検証実験には、類似の反応が必要になってくる。次に述べる酸素と一酸化窒素の反応は、この意味からも貴重な:反応例であるし、無色の気体同志から有色の気体が生成するので視覚的にもよい反応である。
方法
(1) 図のような装置を組み立てる。
100mlメスシリンダーに90ml位のNOを捕集して水中に倒立させておく。
銅網に4M-HNO 3 を加え加熱する。反応が始まれば反応熱で激しく反応するので加熱をやめる。4M-NaOHは気体洗浄用なので無くともよい。
(2) 他の100mlメスシリンダーに90ml位のO 2 を捕集して水中に倒立させておく。
O 2 の発生は過酸化水素と二酸化マンガンを使う。
(3) N0と0 2 を捕集したメスシリンダーを水中で倒立させたまま直立させ、気体の体積を読む。
(4) 0 2 のシリンダーの中にN0を移し入れていく。1回に30〜40cm 3 のN0を入れ、シリンダーをよく振ってかつ色の気体N0 2 を水に溶かす。
(5) 0 2 のシリンダー内が無色であることを確かめ、更に1〜2分間放置してから0 2 とN0の体積を続み記録する。
(6) 同じ操作をN0がなくなるまで続ける。1回ごとのN0と0 2 の反応した体積比を求めてもよいし最終的に反応した全体積の比(上の例では96:46)を求めても結果は大略N0:0 2 =2:1となる。
実験の留意点
(1) NO 2 は有毒なので、NOもN0 2 も空気中にもらさない。実験中は窓を開け、換気に十分気をつける。
(2) 体積測定は正しくはシリンダーの内外の水面を一致させなければならないが、余り大きな差にならないので一致できなくともよい。
(3) 酸素の中に一酸化窒素を入れていく。III オレイン酸分子の大きさの測定
従来の方法は、リコポジウム、チョークの粉、滑石粉末などで水面をおおっておいて実験をしたこの実験で最大の難点は、オレイン酸によって排除された面積が水面上の粉末の種類や厚薄などの原因でさまざまの形を取
|
|
|