|
|
|
福島県教育センター所報ふくしま No.25(S51/1976.2) -010/026page
|
|
|
ら、発熱量は同じだが体積が大きくなっているので温度上昇は少なくなる。温度変化から,溶液の比重(IM-NaOHは1.04 IM-HClは1.20)と比熱(すべてlcal/gdeg)を用いて発熱量を求めてグラフ化すると図5のようになりある体積比のところから以後はほぼ水平になることから,その交点Aが出量点であると考えてよいことになる。
3.電流値の変化
図l,図2においてDE間はイオン数が減少し,EF間ではイオン数が増加するから電流値はグラフのようになると簡単に考えやすいがそれは間違いである。次の反応式から考えてもわかるように
と
を含むところに
と
を加えれば
と
から
が生成して
は減少するが代りに
が同じ数だけ入ってくるので,イオンの総数は変化しない。イオンの種類が変化しているのである。流れる電気量は電場の強さ,イオンの濃度,イオンの電荷数などに比例するが,さらにイオンの移動速度が関係しており,他の条件が同じならば移動速度の大きいイオンは,単位時間に多くの電荷を運ぶ訳である。次に18℃における代表的イオンのイオン移動度を示す。
(lv/cmの電場の中でのイオンの移動速度,cm/sec)
移動度の非常に大きい
が消費されて,移動度の小さい
と置換されるために当量点に達するまでは電流値が減少していく。当量点ではNa+とCl"を含むので電流値は0にならない。当量点を越えると
と
が増加すると共に移動度の大きい
が多量に入ってくるので再ぴ増加して右上りのグラフになる。図6においてA点で測定される電流値はNaClによって運ばれる大きさABと,HClによって運ばれる大きさBCの電流値の和になる。出量点ではNaClによる大きさDHだけである。J点でNaClによるJK(=DH)とNaOHによって運ばれるBCの電流値の和になっている。
HClと NaOH の場合は上のように考えるが,
と
の反応では,次式のように
と
が生成しイオン数が減少していくので電流値は減少し出量点ではイオンがなくなるので電流値は0になる。
当量点以後は
と
の増加によって電流値が大きくなっていくと考えてよい。
中和の出量点は,出量点の前と後の2本の電流値の直線の交点として求められるものなのであって,当量点付近の点を細かに測定したり,出量点を測定から探し出そうとすることは重要な意味を持たない。
表を見て
,
の移動度が異常に大きいことがわかると思う。このことは二つのイオンが他のイオンと異なる機構によって電荷を運ぶためである。
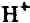
以外のイオンは溶媒の水をかきわけて実際に溶液の申を泳動しなければならないのに,
と
の場合は下図のようにプロトン(
)移動を行なうだけで電荷を遠くへ運ぶことができるからである。
水分子は,水素結合の鎖(上図の……の部分)によって連がっており,それが電場にあると,プロトンはそれぞれ水素結合間を順次同じ方向に移動することによって見かけ上
や
が長い距離移動したことになる。例えば,上図においてプロトンが右へ移動すれば当然
は右へ,
は左へ移動し,電流は右へ流れる。従って,丁度,導線を伝わる信号のように遠方まで伝達されてしまう。要するに,郵便は電話にかなわないのと同様である。
中和反応の取り扱いについて三つの方法を説明したが,なお,問題はまだまだあるがそれらはまた改めて述べたいと思う。
|
|
|