|
|
|
福島県教育センター所報ふくしま No.43(S54/1979.10) -005/034page
|
|
|
小・中・高等学校教材
水溶液の酸性・アルカリ性とその測定
科学技術教育部 佐 久 間 善 克
小学校6年生で「極めてうすい塩酸は,加熱しても特有な臭気を持つ塩化水素が発生しないし,金属を入れても目立った変化を示さない。水と区別する方法として何かないだろうか。」と問いかけている。
そして,「青色リトマス紙に塩酸をつけてみよう。」として,リトマス紙で溶液を区別できることと,「塩酸は酸性を示す。」ことを導入している。酸・塩基の学習は,中学校・高等学校と拡充されていくが小学校6年生は,学習の導入部分に相当し大切なところである。酸・塩基の学習に関係したいくつかの問題を述べてみたい。1 溶液の酸性・アルカリ性の表わし方と測定方法
水自身は酸でも塩基でもなく中性であるが,極くわずかオキソニウムイオンH 3 O + (以下簡単に水素イオンH + で表わす)と水酸化物イオンOH − が含まれている。それは水の中で次のように解離しているからである。
2H 2 0 ⇔ H 3 0 + +OH −
(H 2 0 ⇔ H + +OH − )
純水は中性なので,H + の数とOH − の数が等しく,次の関係が成り立っている。
〔H + 〕=〔OH − 〕= 1.0×10 -7 M/l
但し,〔 〕の記号は濃度を示す。
更に,酸性,アルカリ性の溶液を問わず、水溶液中では常に次の関係式が成り立っている。
〔H + 〕・〔0H − 〕= 1.0×10 -14 (M/l) 2 (25℃)
水溶液中にH + が多くなれば酸性を示し,OH − が多くなればアルカリ性を示す。
即ち
〔H + 〕> 1.0×10 -7 >〔0H − 〕 酸性
〔H + 〕< 1.0×10 -7 <〔0H − 〕 アルカリ性
の関係になっている。
水素イオン濃度〔H + 〕が,1.0×10 -7 や1.0×10 -9 などと表わすのは複雑なので,水溶液中の水素イオン濃度の逆数の常用対数を求めて,その値をPHと表現し,水溶液の酸性,アルカリ性(これらを水溶液の液性と呼ぶことがある)の度合いを示すのに使っている。数学的には次のような関係になる。
PH = log(1/〔H + 〕) = -log〔H + 〕 (1)
この定義に従えば,中性溶液ではPH=7.0,PH<7なら酸性溶液,PH>7ならアルカリ性溶液になる。また数字が小さければ小さい程酸性が強く,反対に大きな数字程アルカリ性が強い。
PHは0から14までの数値で示し,希薄溶液の液性を表わしたい時使用して,濃厚な溶液の時は用いない。しかし,2M−HClのPHは-0.3,4M−NaOHのPHは14.5と計算することはできる。
溶液の液性は,PH試験紙,PH指示薬,PH計などを使って測定する。PH試験紙にはリトマス紙やBTB,(プロムチモールブルー),CR(クレゾールレッド),BCG(プロムクレゾールグリーン),MR(メチルレッド),TB(チモールブルー)などが多く使用され,指示薬としては,MO(メチルオレンヂ),BTB,PP(フェノールフタレイン)などが一般的である。
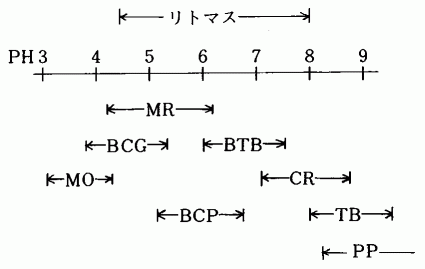
図1 試験紙・指示薬とPHの関係
|
|
|