|
|
|
福島県教育センター所報ふくしま No.43(S54/1979.10) -006/034page
|
|
|
図1の関係からわかるように,リトマス紙はPH4.5以下のとき青リトマス紙が赤変し,PH8.0以上のとき赤リトマス紙が青変する。PHが4.5と8.0の間の溶液は,青,赤いずれのリトマス紙も変色しないので「リトマス紙に対して中性」の溶液になる。小学校ではこのような溶液を中性であると教えている。このように,リトマス紙の変色範囲は広いので大まかな分類にはよいが,細かな測定には不向きなので他の試験紙を用いる。
2 ニ酸化炭素(CO 2 )を溶かした溶液のPH
小学校では炭酸水(二酸化炭素を溶かした溶液)の液性が酸性を示すことをリトマス紙で調べている。中学校では,二酸化炭素の化学的性質の1つとしてリトマス紙との反応を挙げている。
二酸化炭素の水溶液はどの程度の酸性を示すのだろうか。例えば,20℃で1気圧の二酸化炭素を吹き込むと,気体の溶解度から考えて1l中に880mlが溶解する。溶解したCO 2 は次式の平衡状態をとり,溶液中にH + を出すので酸性を示す。
CO 2 +H 2 0 ⇔ H + +HCO 3 -
(またはCO 2 +H 2 0 ⇔ H 2 CO 3 ⇔ H + +HCO 3 - )
HCO 3 - ⇔ H + +CO 3 2-
溶解したCO 2 は,ほとんど気体のままで存在し,ごく僅かしかH + を出さないので弱酸性である。CO 2 を飽和させた溶液のPHは約3.92である。
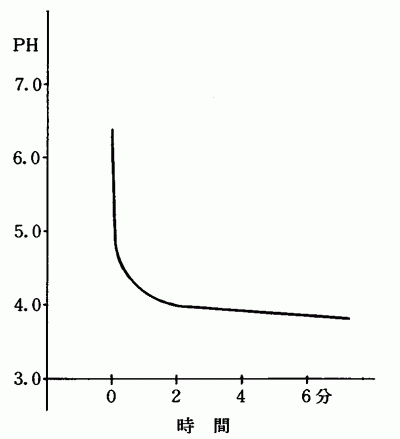
図2 CO 2 の溶解とPHの関係
激しく発生するCO 2 を純水(PH=6.40)50mlに吹き込むと図2のような変化をとって約4〜5分で過飽和になりPH=3.87位の一定値を示す。発生を止めると2〜3分でPH=3.93位になり,その後,徐々にPH値が上って来る。
二酸化炭素が水に溶けて酸性を示す実験は,石灰石に20%(約6M)塩酸(濃塩酸と水をほぼ同体積混合した塩酸)を加えて発生するCO 2 を水に吹き込み,2分位経過してから青色リトマス紙を入れれば十分観察できる。
市販の炭酸水のPHは王冠を取った直後は約4.17(気泡が激しく発生している状態)を示すが,30分後には,4.55位になってしまうので,リトマス紙の変色範囲から考えて,出来るだけ開封直後に測定する。
PH値が大きくなっていくのは,溶解しているCO 2 が空気中に逃げてしまうからである。空気中の二酸化炭素の含量は約0.03%なので,大気圧が1気圧の時二酸化炭素による圧力は,成分の体積比に比例するので,3×10 -4 気圧になり,溶液中のCO 2 はどんどん空気中に逃げて,20℃で1lに0.26mlしか溶けない。このときのPHは約5.73である。従って,PH4.6位の炭酸水は,過飽和状態なので,かきまぜたりすると更にCO 2 が出て来る。
空気と接触している水は,二酸化炭素が溶解している。従って,純水を空気中に放置しておくと,PH5.73位の弱酸性を示すようになる。純水がそれ以下の酸性を示すときは,CO 2 以外の溶解が考えられる。
二酸化炭素の溶解によるPHの変化は次式によって〔H + 〕を求め,その値を(1)式に代人して計算する。
〔H + 〕 3 +K 1 〔H + 〕 2 −〔CO 2 〕K 1 〔H + 〕−K 1 ・K w = 0 (2)
但し,
K 1 はCO 2 の第一電離定数 3.5×10 -7
K w は水のイオン積 1.0×10 -14
〔CO 2 〕は溶解するCO 2 のモル濃度
例えば,
CO 2 の吸収係数0.88 (20℃)
空気中のCO 2 の分圧 3×10 -4 気圧
とすると,空気と接触している水のCO 2 の濃度は次の値をとる。
〔CO 2 〕= 0.88/22.4×3×10 -4 = 1.18×10 -5 M/l
(2)に代入して,〔H + 〕= 1.86×10 -4 が求まり
(1)式から PH=5.73となる。
|
|
|