|
|
|
福島県教育センター所報ふくしま No.43(S54/1979.10) -008/034page
|
|
|
表2 中和滴定曲線の数値計算と実験値
酸
NaoH
の体積酢 酸 塩 酸 計算値 実験値 計算値 実験値 0.0 2.08 2.25 0.00 0.12 10.0 4.58 4.55 0.37 0.31 15.0 4.93 4.90 0.60 0.55 20.0 5.36 5.40 0.95 0.86 22.0 5.62 5,62 1.19 1.10 22.5 5.71 5.72 1.28 1.20 23.0 5.82 5.90 1.38 1.30 23.5 5.95 6.00 1.51 1.41 24.0 6.14 6.22 1.69 1.60 24.5 6.45 6.50 2.00 1.90 25.0 8.98 10.71 7.00 5.96 25.5 12.00 12.00 12.00 11.52 26.0 12.29 12.35 12.29 11.91 26.5 12.46 12.60 12.46 12.09 27.0 12.59 12.75 12.59 12.22 30.0 12.96 13.10 12.96 12.59
酢酸,塩酸,水酸化ナトリウムの濃度はいずれも1.OM,酸の体積は25.Oml使用
計算結果をグラフ化すると図3のようになる。
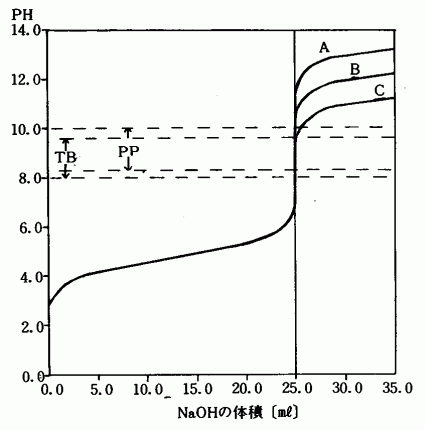
図3 酢酸−水酸化ナトリウムの中和滴定曲線
曲線A l.0M−CH 3 COOHと1.0M−NaOH
曲線B 0.1M−CH 3 COOHと0.1M−NaOH
曲線C O.01M−CH 3 COOHと0.01M−NaOH
TB,PPは指示薬の変色範囲を示す。(2)塩酸と水酸化ナトリウムの中和
この場合は酢酸の場合と異なり2次式で表わされる。
[H + ] 2 +((VOH・MOH−VH・MH)/(VH+VOM))[H + ]−K W = 0 (4)
計算値と実験値は表2に示した。グラフは図4のようになる。
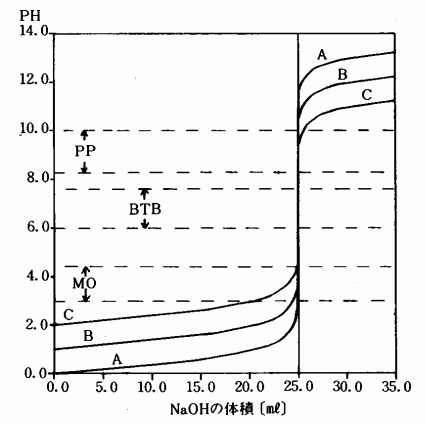
図4 塩酸と水酸化ナトリウムの中和滴定曲線
曲線A 1.0M−HClと1.0M−NaOH
曲線B O.1M−HClと0.1M−NaOH
曲線C 0.01M−HClと0.01M−NaOH
MO,BTB,PPは指示薬の変色範囲を示す。表2の計算値と実験値を比較してみると精度の高い実験であることがわかる。また,2つのグラフから弱酸と強酸の違い,濃度による指示薬の選択の問題,中和点におけるPHジャンプの様子などが良く理解される。
複雑な理論式であるが,それを解いて得られる結果からは,色々な情報を得ることができるので,最近普及している優れた計算機で数値計算をして,教材に活用して欲しいと思います。なお,詳しい計算値が必要な場合は当センター化学室に問い合わせていただきたいと思います。
参考文献
- George M.Fleck著 水町邦彦訳 溶液内の化学平衡 丸善
- 化学 第9巻第1号 P.56(1954年) 理工出版社
|
|
|