|
|
|
福島県教育センター所報ふくしま No.61(S58/1983.06) -010/042page
|
|
|
実験値の平均 0.919g/ml 文献値 0.915g/ml
2 52 48.2 0.926 3 44 40.2 0.914 5 水の気化熟と融解熟の測定
高等学校の選択化学においては,相変化に伴ってエネルギーが出入りすることを分子運動との関連において捕らえさせることになっている。これらの理解を深めさせるには,実験を行わせる必要があるが,一般に熱に関する実験の誤差は大きい。しかし,実験方法を次のように工夫すると比較的良好な結果が得られる。
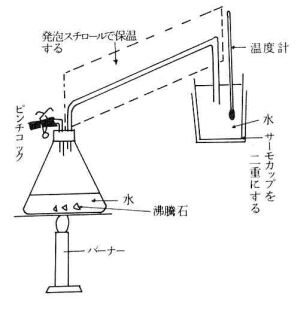
(1) 水の気化熱の測定
1 実験方法の概要と測定上の留意点発生させた水蒸気を水中に導き,水の温度上昇と凝縮させた水蒸気の量から,気化熱を算出する。この方法においては,水蒸気を水の中に通すときに,すでに凝縮した水が入るのをできるだけ少なくし,水蒸気の凝縮によって発生した熱量の損失を押える必要がある。このため,装置を図のように組み立て,水蒸気誘導用のガラス管を発泡スチロールで保温する。また,水蒸気凝縮用の容器には,肉厚のインスタント食品用の容器を2個重ねて使用する。2 実験方法
ア 三角フラスコに約150ml(ミリリットル)の水を入れ,沸騰石を加えて,ピンチコックを開けた状態で加熱沸騰させる。次にピンチコックを閉めて,蒸気誘導管やその他の器具を十分に加熱する。
イ ピンチコックを開き,誘導管中の水滴を除いた後,再び閉める。
ウ 乾燥させたサーモカップの質量(m1)を求め,さらに,これにおよそ300ml(ミリリットル)の水を入れ・全質量(m2)と水温(t1)をはかる。
エ 水中に蒸気を通した後,水温がはぼ15℃上昇したら,水蒸気の誘導管をすばやく取りはずしよく撹拌した後,水温(t2)とサーモカップの全質量(m3)をはかり,次式に従って気化熱を算出する。気化熱(cal/g)=(m2−m1)(t2−t1)+(m2−m3)(100−t2)/m3−m2
3 実験結果の例
回数 m1
(g)m2
(g)m3
(g)t1
(℃)t2
(℃)気化熱
cal/g1 11.4 316.3 324.9 19.1 35.7 524 2 11.2 320.7 328.3 19.1 33.7 528 3 11.4 322.8 330.4 19.1 33.5 524
文献値539Cal/g(2) 氷の融解熱の測定
1 実験方法の概要と実験上の留意点
一定量の氷を水に入れ,融解前後の温度差より融解熱を算出する。この方法において実験誤差を少なくするには,氷を融解させる容器の断熱効果を高めることと,すでに融解した氷の表面の水をガーゼ等で十分ふき取ってから,実験することが大切である。
2 実験方法
ア 市販のサーモカップを2個重ねて秤量(m'1)する。これに約100ml(ミリリットル)の室温の水を入れ,再び全質量(m'2)をはかった後,水温(t'1)を測定する。
イ 室温に放置した0℃の氷を約10g取って,水を入れたサーモカップに投入して融解する。十分撹拌した後,水温(t'2)と全量(m'3)をはかり,次式に従がって,融解熱を算出する。融解熱(cal/g)=(m'2−m'1)(t'1−t'2)−(m'3−m'2)t'2/m'3−m'2
3 実験結果の例
回数 m'1
(g)m'2
(g)m'3
(g)t'1
(℃)t'2
(℃)融解熱
cal/g1 6.12 107.7 115.1 29.4 21.9 81 2 6.18 105.4 116.5 27.7 16.9 79 3 6.18 107.8 113.4 27.4 21.9 79
文献値 Cal/g6 おわりに
水は身近な物質なので,その性質は広く知られているが,実験で確かめてみると必ずしも知識通りの結果にはならない。しかし,それらの原因を考察し,実験方法を工夫すればよりよい結果を得ることができる。実験によって,水への理解を深めさせ,化学実験の基本操作にも習熟させたいものである。
参考文献 化学の基礎(丸善)実験観察大事典 (東京書籍)化学実験の基礎と止得(培風館)
|
|
|