(イ)電量計の下方の活栓を開き,電解装置と直列につないだ後,電源に接続して電気分解を行う。
(ウ)電量計の液面が20cm下降したら,電気分解を中止し,電解生成物の量を記録する。
(エ)次に,電極を面積の小さい白金線電極にとりかえて,同様に実験する。
(オ)ホフマンの電解装置の電解液を0.5M硫酸に入れ替えて同様に実験する。
※ 以上の実験はいずれも同じ実験を3回行い3回の平均を実験値とする。
イ 実験結果の例
(ア)電極の面積
| 電極の種類 |
陽極 |
陰極 |
| 白金ハク |
20.7ml |
10.5ml |
| 白金線 |
20.5ml |
10.3ml |
(イ)電解液の濃度(白金線電極使用)
| 電解液の濃度 |
陽極 |
陰極 |
| 0.5MH2SO4 |
20.5ml |
10.1ml |
| 2MH2SO4 |
20.5ml |
10.3ml |
ウ 考察と留意点
(ア)実験結果から,電解生成物の量は,電極の大きさや電解液の濃度に関係なく,流れた電気量によって決まることが確認できる。
(イ)実験を行う際,次のことに留意する必要がある。
ア)いずれの場合も,電解時の電流を多くしない。
イ)予備実験を行い,電解液に酸素や水素を十分溶解させてから検証実験を行う。
ウ)電量計の液面の高さがほぼ同じ高さから20cm下降するまでの量を測定する。
4)自作の電量計を用いた電気分解第一法則の検証
ア 実験方法
(ア)約20cmの銅線をよくみがいて,ら線状にしたものを二本用意し,そのうち陰極に使用する電極の質量を正確に秤量する。
(イ)銅電極を10%硫酸銅に入れて,自作の電量計に直列に接続し,電気分解を行う。電量計の液面の高さが5cm下降したら電解を中止し,陰極側の銅線をとりだし,純水の中に数回出し入れをして洗浄する。
(ウ)洗浄後,ドライヤーなどで乾燥させた後秤量する。
(エ)この実験を電量計の液面の高さを,10cm,15cm,20cmと変化させて行う。
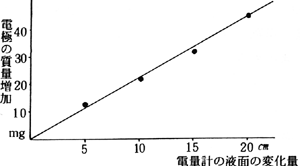
イ 実験結果の例
| 電量計の目盛 |
電極の質量増加 |
| 5cm |
12mg |
| 10cm |
22mg |
| 15cm |
32mg |
| 10cm |
45mg |
ウ 実験上の留意点
○電流密度を大きくすると,銅の付着があらくなり,実験結果にばらつきが見られるので電圧を低くして,電解を行う。